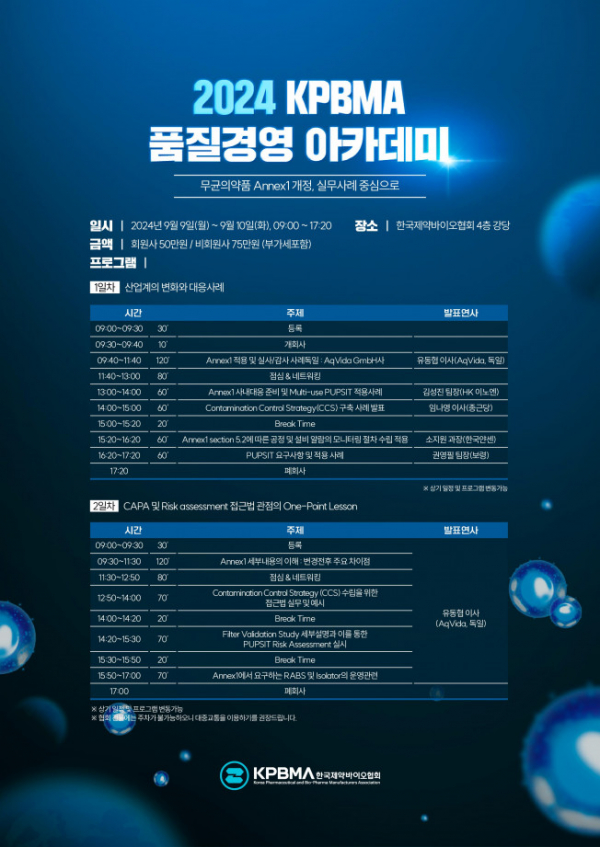
한국제약바이오협회는 9월 9~10일 양일간 제약회관 4층 대강당에서 ‘무균의약품 Annex1 개정, 실무사례 중심으로’를 주제로 KPBMA 품질경영 아카데미를 개최한다고 12일 밝혔다.
앞서 지난해 12월 식품의약품안전처가 유럽 의약품청(EMA)의 ‘무균의약품 제조공정 가이드라인(EU GMP Annex1) 개정에 따라 ‘무균의약품 제조 및 품질관리 기준’을 개정 고시한 바 있다. 이에 협회는 업계의 규제 준수 이행을 돕고 품질관리 능력을 대폭 높이고자 이번 아카데미를 마련했다.
‘산업계의 변화와 대응사례’를 주제로 하는 1일 차는 독일 항암제 전문회사 아크비다(AqVida GmbH) 유동협 이사가 Annex1 적용 및 실사·감사 사례에 대해 강연한다.
이어 △김성진 HK이노엔 생산팀장은 Annex1 사내 대응 준비 및 다용도(Multi-use) 사용 전 멸균 후 무결성 테스트(Pre-Use Post Sterilisation Integrity Testing, PUPSIT) 적용 사례를 공유한다. △임나영 종근당 이사는 오염관리 전략(Contamination Control Strategy, CCS) 구축사례 △소지원 한국얀센 MSAT 과장은 Annex1 section 5.2에 따른 공정 및 설비 알람의 모니터링 절차 수립 적용사례 △권영필 보령 QA팀장은 PUPSIT 요구사항 및 적용사례를 발표한다.
2일 차에는 생산능력(CAPA) 및 위험 관리(Risk assessment) 접근법 관점의 원포인트 강의(One-Point Lesson)를 주제로 유동협 이사가 4개의 세션을 진행한다.
유 이사는 △Annex1 세부내용의 이해 : 변경전후 주요 차이점을 시작으로 △CCS 수립을 위한 접근법 실무 및 예시 △필터 검증 연구(Filter Validation Study) 세부설명과 이를 통한 PUPSIT 위험 관리(Risk assessment) 실시 △Annex1에서 요구하는 RABS 및 Isolator의 운영 등에 대해 설명하고 이와 관련한 질의 응답 시간도 이어진다.
한국제약바이오협회 관계자는 “개최에 앞서 시행한 설문조사에서 PUPSIT의 실제적인 구현 방법과 CCS 적용 사례와 표준화 경향에 대한 니즈가 많았고, 실제 GMP 실사대응 준비에 대한 요구도가 높았다”면서 “특히 시설 보완이 어려운 경우 관리방안에 대한 궁금증이 대다수를 차지했다”고 밝혔다.
이어 이 관계자는 “이번 아카데미를 통해 개정된 규정에 대한 업계 대응 전략을 공유해 제약바이오산업의 품질관리 표준을 높이는 데 기여할 것”이라고 기대했다.
한편 이번 아카데미 GMP 관련 종사자 대상으로 진행하며, 교육은 한국제약바이오협회 내 패밀리사이트 메뉴 중 교육통합센터에서 선착순으로 신청 가능하다.

!["이미 결제된 선수입니다"…본격 막 올린 스토브리그, '변수'는 없을까? [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2098040.jpg)
![먹을 사람 없고 귀찮아서…"김장, 안 하고 사 먹어요" [데이터클립]](https://img.etoday.co.kr/crop/140/88/2098061.jpg)

![[단독] "AI에 진심" 정태영 부회장, '유니버스' 중동 세일즈 나섰다](https://img.etoday.co.kr/crop/140/88/1970536.jpg)






![[내일 날씨] 전국 대부분 아침 기온 5도 내외…얼음 어는 곳도](https://img.etoday.co.kr/crop/85/60/2098154.jpg)









![[정치대학] 美 대선, 막판까지 초박빙…당선자별 韓 영향은?](https://img.etoday.co.kr/crop/300/170/2098110.jpg)
!['한국의 장 담그기 문화' 유네스코 무형문화유산 등재 유력 [포토]](https://img.etoday.co.kr/crop/300/190/2098066.jpg)