온코닉테라퓨틱스는 국산 37호 신약 위식도역류질환 치료제 ‘자큐보정(성분명 자스타프라잔)’의 임상 3상 결과가 과학기술논문인용색인확장판(SCIE)급 미국 소화기학 분야 의학 학술지(American Journal of Gastroenterology)에 게재됐다고 21일 밝혔다.
회사에 따르면 게재된 논문명은 ‘Randomized, double-blind, active-controlled phase 3 study to evaluate efficacy and safety of zastaprazan compared with esomeprazole in erosive esophagitis’로, 칼륨경쟁적 위산분비억제제(P-CAB) 계열인 자스타프라잔의 유효성·안전성에 관한 임상 3상 시험이다. 해상 임상은 미란성 위식도역류질환 환자를 대상으로 대조군인 프로톤펌프저해제(PPI) 계열 약물 에스오메프라졸과 비교 연구한 결과다.
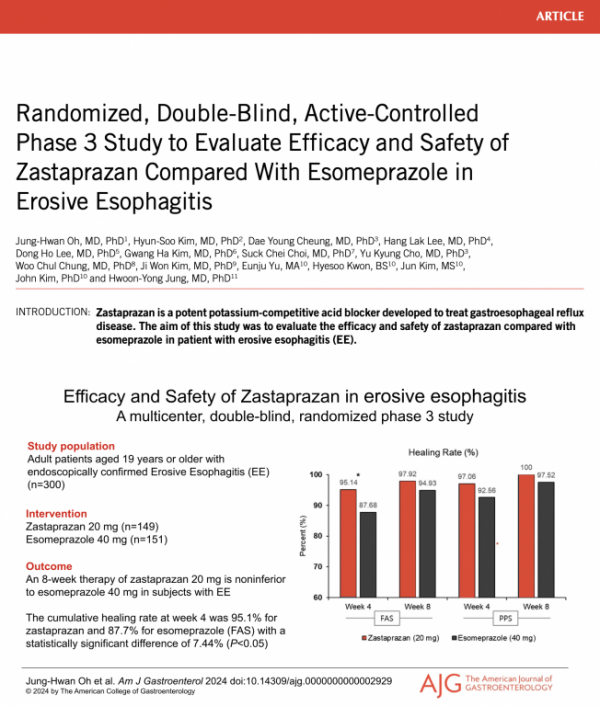
이번 임상 3상 시험은 정훈용 서울아산병원 소화기내과 교수 주도로 국내 주요 병원에서 내시경상 미란성 위식도역류질환 환자 300명을 대상으로 이중눈가림, 무작위 배정을 통해 자스타프라잔 20㎎(149명), 대조군 에스오메프라졸 40㎎(151명)으로 나눠 최대 8주 동안 투여했다.
임상에 의하면 8주 투여 후 자스타프라잔은 97.9%의 높은 치료율로 대조군의 94.9% 대비 우수한 효능을 확인했다. 4주 투여 시 자스타프라잔의 치료율은 95.1%로 대조군에서 보인 87.7%보다 7.44% 높은 치료율을 보이며 신속하게 효능이 발휘되는 것을 확인했다.
부작용 분석결과 자스타프라잔과 대조군 간의 통계적 차이는 없었다. 따라서 안전성에 측면에서 오랫동안 표준치료제로 사용됐던 에스오메프라졸과 비슷해 특별한 부작용이 나타나지는 않으리라고 기대된다.
현재 자스타프라잔은 이미 허가 받은 미란성 위식도역류질환뿐만 아니라 위궤양 및 비스테로이드성 소염진통제(NSAID) 유도성 소화성 궤양 예방 적응증 등으로 확대하기 위한 임상시험을 진행하고 있다.
김존 온코닉테라퓨틱스 대표는 “세계적인 소화기 저널에 3상 시험 논문이 게재돼 전 세계 의료진에게 K-신약인 자스타프라잔의 임상 결과를 공유하게 되어 기쁘다”며 “앞으로 한국 및 해외에서의 빠른 상용화를 위해 최선을 다할 것이며, 적응증 확대에도 역량을 집중할 것”이라고 강조했다.
한편 온코닉테라퓨틱스는 지난해 3월 중국 제약기업 리브존파마슈티컬그룹과 중화권 내 자스타프라잔 개발 및 상업화와 관련 1억2750만 달러(약 1600억 원) 규모의 기술수출 계약을 체결했다.

!["이미 결제된 선수입니다"…본격 막 올린 스토브리그, '변수'는 없을까? [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2098040.jpg)
![먹을 사람 없고 귀찮아서…"김장, 안 하고 사 먹어요" [데이터클립]](https://img.etoday.co.kr/crop/140/88/2098061.jpg)

![[단독] "AI에 진심" 정태영 부회장, '유니버스' 중동 세일즈 나섰다](https://img.etoday.co.kr/crop/140/88/1970536.jpg)







![[내일 날씨] 전국 대부분 아침 기온 5도 내외…얼음 어는 곳도](https://img.etoday.co.kr/crop/85/60/2098154.jpg)









![[정치대학] 美 대선, 막판까지 초박빙…당선자별 韓 영향은?](https://img.etoday.co.kr/crop/300/170/2098110.jpg)
!['한국의 장 담그기 문화' 유네스코 무형문화유산 등재 유력 [포토]](https://img.etoday.co.kr/crop/300/190/2098066.jpg)