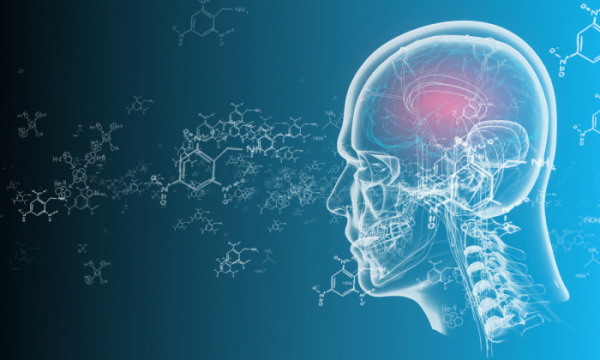
글로벌 기업들이 알츠하이머 치료제 개발에 성공하면서 국내 바이오기업이 반사 이익을 볼 수 있다는 기대감이 나오고 있다. 알츠하이머 신약이 국내로 도입되면, 알츠하이머 진단검사에 활용되는 방사성의약품 전문 바이오 업계가 급부상할 수 있어서다.
14일 제약·바이오업계에 따르면 최근 미국 식품의약국(FDA)이 일라이릴리의 알츠하이머 치료제 ‘도나네맙’을 허가했다. 도나네맙은 뇌 속에 비정상적으로 축적돼 질병을 유발하는 유해 단백질인 아밀로이드 베타를 표적 제거하는 기전이다. 제품명 키순라(Kisunla)로 미국 시장에 공급될 예정이다.
FDA가 알츠하이머를 적응증으로 신약을 허가한 사례는 도나네맙이 세 번째다. 지난해 7월에는 바이오젠과 에자이가 공동 개발한 ‘레카네맙’이 FDA 허가를 획득했고, 국내에서는 식품의약품안전처가 올해 5월 레카네맙을 허가했다.
이보다 앞서 에자이와 바이오젠은 2021년 ‘아두카누맙’을 알츠하이머 치료제로 FDA에서 최초 허가를 받았다. 하지만, 효과성 논란과 부작용 이슈가 지속해 발생함에 따라 상용화에 실패했다.
알츠하이머 치료제 시장이 태동하면서 이와 관련된 방사성의약품 전문 기업들이 조명을 받게 됐다. 도나네맙과 레카네맙을 활용해 환자를 치료하려면, 투약에 앞서 환자의 뇌 속에 존재하는 아밀로이드 베타를 측정해야 한다. 이를 위해 양전자방출 컴퓨터단층촬영(PET CT)을 시행하는데, 이때 일종의 조영제 역할을 하는 방사성의약품이 사용된다.
국내 기업 가운데 듀켐바이오는 방사성의약품 진단 시장 점유율 선두로 평가받는다. 국내 PET용 방사성의약품 시장에서 가장 많은 품목을 보유하고 있으며, 제조 시설도 12개로 국내에서 가장 많다.
현재 보유 중인 파이프라인 가운데 치매 진단용 ‘Cerveau MK-6240’과 치매 및 진행성 핵상마비 진단용 ‘LMI PI-2620’은 임상 1, 2상 단계에 있고, 3년 내 제품화를 목표로 개발 중이다. 도나네맙과 레카네맙 등의 등장이 회사의 성장 기회가 될 것으로 점쳐진다.
퓨쳐켐도 알츠하이머 치료제와 함께 성장 기회를 모색할 수 있는 국내 바이오기업으로 꼽힌다. 특히, 이번 도나네맙의 FDA 허가에 따른 수혜가 상당할 것으로 예상된다. 퓨쳐켐은 2022년 4월 일라이릴리의 미국 계열사 아비드와 총 125만9000달러(17억3540만 원) 규모의 임상시험용 방사성 의약품 위탁생산 및 공급계약을 체결한 바 있다.
이에 국내 기업들이 글로벌 알츠하이머 치료제를 발판 삼아 성장 기회를 잡을 수 있을지 관심이 쏠린다. 다만 업계는 아직까지 도나네맙과 레카네맙 등의 시장이 형성 초기 단계에 있고, 국내 도입 시기도 미지수인 만큼 시간을 두고 지켜봐야 한다는 입장이다.
제약·바이오업계 한 전문가는 “레카네맙은 식약처 허가를 얻었지만 아직 의료현장에 본격 도입되지 않았고, 도나네맙은 국내 도입이 추진될지 아직은 알 수 없다”라며 “신약 허가와 시장 출시 및 상용화는 또 다른 문제로, 방사성의약품 기업들이 장기적인 안목으로 성장 모멘텀을 탐색해야 할 것”이라고 내다봤다.

![[단독]내일부터 암, 2대 주요치료비 보험 판매 중지된다](https://img.etoday.co.kr/crop/140/88/2105043.jpg)
!["아이 계정 삭제됐어요"…인스타그램의 강력 규제, '진짜 목표'는 따로 있다? [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2105286.jpg)
![근무시간에 유튜브 보고 은행가고…직장인 10명 중 6명 '조용한 휴가' 경험 [데이터클립]](https://img.etoday.co.kr/crop/140/88/2105320.jpg)

![[단독] LG 생성형 AI ‘엑사원’에 리벨리온 칩 ‘아톰’ 적용되나…최적화 협업 진행](https://img.etoday.co.kr/crop/140/88/2105118.jpg)
![[인터뷰] 조시 팬턴 슈로더 매니저 “K-채권개미, 장기 투자로 美은행·통신·에너지 채권 주목”](https://img.etoday.co.kr/crop/140/88/2105216.jpg)












![김덕헌 이투데이 대표 “CSR은 기업 이익 창출 넘어 사회적 책임” [2024 CSR 필름페스티벌 어워드]](https://img.etoday.co.kr/crop/85/60/2105289.jpg)
![[정치대학] 이재명 대안은 김부겸·김동연?…박성민 "둘 다 명분 없다"](https://img.etoday.co.kr/crop/300/170/2105457.jpg)
![서울 명동 임대료, 세계 9번째로 '비싸' [포토]](https://img.etoday.co.kr/crop/300/190/2105411.jpg)